- 首页
-
产品
- 多分散聚乙二醇衍生物
- 单分散聚乙二醇衍生物
- 脂质
- 脂肪酸修饰侧链
-
嵌段共聚物
- 线性两嵌段
- 双V两嵌段
- H型两嵌段(Y嵌段和V嵌段的组合,或两个Y的组合)
- 1+3臂两嵌段
- 线性三嵌段(ABA,BAB,ABC)
- 三臂Y型两嵌段(V+I型,也可以称为T型)
- 三臂三嵌段(3个臂都不一样的嵌段)
- H型三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型三嵌段III(中间一,两头Y)
- 星型多嵌段(中间星型和中间环型嵌段)
- 单官能化线性两嵌段
- 双官能化线性两嵌段
- 异端官能化线性两嵌段
- 双V(单嵌段双官能化)两嵌段(一个V嵌段的两个末端是一样的官能化)
- 双V(异嵌段双官能化)两嵌段
- H型(单嵌段双官能化)两嵌段(Y嵌段和V嵌段的组合,或两个Y的组合)
- H型(异嵌段双官能化)两嵌段(Y嵌段和V嵌段的组合,或两个Y的组合)
- 1+3臂(单嵌段双官能化)两嵌段
- 1+3臂(三官能化)两嵌段
- 1+3臂(异嵌段双官能化)两嵌段
- 单官能化线性三嵌段(ABA,BAB,ABC)
- 双官能化线性三嵌段(ABA,BAB,ABC)
- 异官能化线性三嵌段(ABA,BAB,ABC)
- 三臂Y型(单嵌段I单官能化)两嵌段(V+I型,也可以称为T型)
- 三臂Y型(单嵌段V双官能化)两嵌段(V+I型,也可以称为T型)
- 三臂Y型(三官能化)两嵌段(V+I型,也可以称为T型)
- 三臂Y型(嵌段I和V异官能化)两嵌段(V+I型,也可以称为T型)
- 三臂(单嵌段官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(两嵌段双官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(两嵌段异官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(三官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(三嵌段异官能化)三嵌段(3个臂都不一样的嵌段)
- H型(I或V单嵌段双官能化)三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型(四官能化)三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型(I或V单嵌段双官能化)三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型(I或V单嵌段异官能化)三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型(I单嵌段双官能化)三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型(四官能化)三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型(I单嵌段异官能化)三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型(Y单嵌段双官能化)三嵌段III(中间一,两头Y)
- H型(四官能化)三嵌段III(中间一,两头Y)
- H型(双Y嵌段双官能化)三嵌段III(中间一,两头Y)
- H型(双Y嵌段异官能化)三嵌段III(中间一,两头Y)
- 官能化星型多嵌段(中间星型和中间环型嵌段)
- 聚两性离子
- 聚酯
- 糖类
- 其他辅料
- 转染试剂
- 蛋白修饰
- 多肽修饰
- GLP-1修饰
- GLP-1辅料
- 水凝胶
- 3D打印
- 点击化学物质
- PROTAC/ADC Linker
- 与各种官能团的反应
- mRNA递送
- 小核酸递送
- 脂质体
- 聚合物胶束
- PEG标准品
- PEG辅料
- 转染
- 根据官能团分类
- 技术
- 服务
- 新闻
- 联系


- 首页
-
- 线性两嵌段
- 双V两嵌段
- H型两嵌段(Y嵌段和V嵌段的组合,或两个Y的组合)
- 1+3臂两嵌段
- 线性三嵌段(ABA,BAB,ABC)
- 三臂Y型两嵌段(V+I型,也可以称为T型)
- 三臂三嵌段(3个臂都不一样的嵌段)
- H型三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型三嵌段III(中间一,两头Y)
- 星型多嵌段(中间星型和中间环型嵌段)
- 单官能化线性两嵌段
- 双官能化线性两嵌段
- 异端官能化线性两嵌段
- 双V(单嵌段双官能化)两嵌段(一个V嵌段的两个末端是一样的官能化)
- 双V(异嵌段双官能化)两嵌段
- H型(单嵌段双官能化)两嵌段(Y嵌段和V嵌段的组合,或两个Y的组合)
- H型(异嵌段双官能化)两嵌段(Y嵌段和V嵌段的组合,或两个Y的组合)
- 1+3臂(单嵌段双官能化)两嵌段
- 1+3臂(三官能化)两嵌段
- 1+3臂(异嵌段双官能化)两嵌段
- 单官能化线性三嵌段(ABA,BAB,ABC)
- 双官能化线性三嵌段(ABA,BAB,ABC)
- 异官能化线性三嵌段(ABA,BAB,ABC)
- 三臂Y型(单嵌段I单官能化)两嵌段(V+I型,也可以称为T型)
- 三臂Y型(单嵌段V双官能化)两嵌段(V+I型,也可以称为T型)
- 三臂Y型(三官能化)两嵌段(V+I型,也可以称为T型)
- 三臂Y型(嵌段I和V异官能化)两嵌段(V+I型,也可以称为T型)
- 三臂(单嵌段官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(两嵌段双官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(两嵌段异官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(三官能化)三嵌段(3个臂都不一样的嵌段)
- 三臂(三嵌段异官能化)三嵌段(3个臂都不一样的嵌段)
- H型(I或V单嵌段双官能化)三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型(四官能化)三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型(I或V单嵌段双官能化)三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型(I或V单嵌段异官能化)三嵌段(中间一型嵌段,和两头I或V型嵌段)
- H型(I单嵌段双官能化)三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型(四官能化)三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型(I单嵌段异官能化)三嵌段II(中间H型嵌段,和四个I型末端嵌段)
- H型(Y单嵌段双官能化)三嵌段III(中间一,两头Y)
- H型(四官能化)三嵌段III(中间一,两头Y)
- H型(双Y嵌段双官能化)三嵌段III(中间一,两头Y)
- H型(双Y嵌段异官能化)三嵌段III(中间一,两头Y)
- 官能化星型多嵌段(中间星型和中间环型嵌段)
- 技术
- 服务
- 新闻
- 联系
2022年04月03日,石药集团公告,其自主研发的新冠mRNA疫苗SYS6006已获国家药品监督管理局批准,可开展于中国的临床研究。次日(2022年04月04日)康希诺生物在港交所公告,其开发的新冠mRNA疫苗已获得国家药品监督管理局药物临床试验批件。自此,国内获批临床的新冠mRNA来到7家。
石药集团公告当日,媒体还报道斯微生物正在加速研发新冠mRNA迭代疫苗,目前已向国家药监局递交了纸质申请,开展临床试验,争取早日获批上市。
表1 国内获批临床的新冠mRNA疫苗|
序号 |
企业 |
研发名称 |
阶段 |
|
1 |
艾博生物/沃森生物 |
ARCoVaX |
III期 |
|
2 |
斯微生物 |
SW0123(DF104B1) |
I/II期 |
|
3 |
艾美疫苗(丽凡达生物) |
LVRNA009 |
II期 |
|
4 |
云顶新耀(Providence) |
PTX-COVID19-B |
II期 |
|
5 |
锐博生物/阿格纳生物 |
- |
II期 |
|
6 |
石药集团 |
SYS6006 |
I期 |
|
7 |
康希诺生物 |
- |
I期 |
一、康希诺生物:协作开发mRNA疫苗
康希诺生物公告中指出,其新冠mRNA疫苗是针对现有变异株有更好保护效果的新一代疫苗。临床前研究结果显示,该款疫苗可以诱导出针对多种世界卫生组织认定的重要变异株(包括当前流行株)的高滴度中和抗体,与以原型株为基础开发的现有新冠疫苗相比广谱性更强,可以更有效地保护机体免受现有变异株的感染。

图1 LNP结构示意图
康希诺生物早在2018年开始布局mRNA技术平台,拥有自主设计、开发的序列优化软件,可得到影响稳定性的关键位点及有效提高抗原表达量的最优序列。在专利、工艺、mRNA序列设计等方面有较厚储备,已建立多条创新型预防性疫苗产品管线。开发的mRNA通用型工艺能有效缩短开发时间,有助于产品放大生产。从目前汇集的多方信息中可看出,康希诺生物的新冠疫苗可能是自主设计mRNA疫苗,在辅料和生产技术方面与其他企业合作。
康希诺生物已公布与mRNA相关的专利有四项。最早于2020年02月申请的专利已授权,里面包含了蛋白苗、腺病毒疫苗、mRNA疫苗三种技术路线。在2021年的01月和05月分别申请的两项专利都与mRNA序列设计有关,而在2022年01月提交的专利中,康希诺生物申请11种新型的可电离脂质,可用于生物活性物质对靶细胞或器官的高效稳定递送。
2020年05月21日,康希诺生物和PrecisionNanoSystems公司(PNI)达成共同开发新型冠状病毒mRNA脂质纳米粒疫苗(简称mRNA-LNP疫苗)的协议。该协议中康希诺生物获得PNI的专有RNA疫苗平台技术(NanoAssemblr®纳米药物制造系统)用于疫苗制剂的开发,而康希诺生物负责新冠病毒抗原设计、临床前测试、人体临床试验、监管批准和商业化。权利方面,康希诺生物拥有在亚洲地区(日本除外)商业化疫苗产品的权利,PNI公司拥有在全球其它地区商业化疫苗产品的权利。
二、石药集团:自主解决疫苗关键挑战
石药集团公告中描述,SYS6006根据毒株的流行情况进行针对性的抗原突变设计,临床前研究表明,该产品对包含奥密克戎(Omicron)和德尔塔(Delta)在内的当前主流突变毒株具有良好的免疫保护效力;通过体液免疫和细胞免疫对机体提供免疫保护,并可产生记忆性B细胞,提供长效保护效力。
此外,临床前安全性评价数据也充分证明了该产品的安全性。该产品使用先进的生产技术,工艺过程高度可控,批间一致性好,容易实现放大和产业化;而且稳定性好,可在2~8℃长期储藏。石药集团对mRNA技术的关键生产原料和辅料实现了内化生产和国产化替代,可满足大规模产能供应需求。基于在安全性、有效性以及产业化方面的优势,并根据疫情防控的需要,该产品被国家药品监督管理局列入特别审批程序,快速批准进入临床。
图2 石药新冠mRNA疫苗获批临床
根据石药集团2021年底的公告,mRNA疫苗产业化项目总投资10亿元,其中新冠mRNA疫苗的年产能为10亿支。此外,在3月23日的石药集团业绩电话会上表述,SYS6006已经进行了IIT研究,规模为70人。初步数据来看,两针灭活疫苗加一针石药mRNA疫苗,其总抗体水平优于三针灭活10倍以上,与国外三针mRNA的总抗体水平相当甚至更好。
图3 SYS6006临床前数据
mRNA疫苗生产工艺复杂繁琐,必须对从质粒的获取、体外转录与纯化、脂质纳米粒的设计和制剂稳定性等多个工艺进行严格控制。石药集团本次公告中提到解决了四大关键挑战:
1 自主研发
SYS6006为针对新冠病毒变异株抗原突变自主研发设计,对包含奥密克戎(Omicron)和德尔塔(Delta)在内的当前主流突变毒株具有良好的免疫保护效力。尽管BioNTech和Moderna公司分别开发上市了mRNA新冠疫苗Comirnaty和Spikevax,但关于专利的纠纷却从未停止。由于国外在mRNA领域布局较早,专利分布较广,国内企业需要绕开mRNA序列设计和LNP专利并拥有自主知识产权。据有关报道,石药集团研发的疫苗采用具有自主知识产权的新型阳离子脂质,优化LNP处方,实现mRNA疫苗的有效递送,便于同时向海外申请临床试验,通过专利布局走向国际化。
图4 石药集团八大创新技术平台
2 稳定性好
mRNA疫苗的稳定性存在两个难题:LNP发生聚集和融合,包载的mRNA发生泄露和降解。LNP的聚集和融合可通过加入聚乙二醇(PEG)脂质来避免,但包载的mRNA在非冷冻存储期间的稳定性是很难解决的,例如Moderna的新冠疫苗Spikevax在要求的-20℃储存温度下可保存6个月,在2~8℃中仅能保存4周;BioNTech/Pfizer新冠疫苗Comirnaty在-70℃超低温可保存6个月,在-20℃中可保存2周,而在2~8℃中仅能保存5天。严苛的温度存储条件会增加运输和储存成本,甚至会影响产品在终端使用时的质量保证。同时,对低温的要求也会因限制分装和运输影响产能。
石药集团的SYS6006可在2~8℃条件下长期储藏。两个月前国内已有公司采用冻干技术实现对包载mRNA的LNP在4℃和25℃的制剂稳定,极大地提高了疫苗的可及性。鉴于石药集团在高端制剂领域的优势,既有注射用两性霉素B脂质体、注射用柔红霉素阿糖胞苷脂质体等冻干制剂,也有盐酸米托蒽醌脂质体注射液、伊立替康脂质体注射液等注射液制剂,尽管不清楚SYS6006为哪一种剂型,但相信石药集团有这样的能力。
3 易于产业化
LNP的制备方法有薄膜水化法、挤出法、均质法、微流控混合法以及冲击式射流混合法。制备后需要以切向流过滤进行缓冲液置换并纯化,之后进行除菌过滤。工业上多采用微流控混合法和冲击式射流混合法进行生产。这种高精度设备对结构和参数要求较高,属于商业机密,以Moderna和BioNTech为代表的公司都是与设备供应商排他性合作。
石药集团以设计的新型交叉流混合装置代替微流控设备,该先进的生产技术工艺过程高度可控,可得到稳定的纳米粒子,重现性更好批间差异小,更易于实现放大和产业化。
4 原辅料国产替代
SYS6006中的mRNA原料和可电离阳离子脂质(Moderna的Spikevax和Pfizer的Comirnaty分别使用SM-102和ALC-0315)由石药集团自主研发内化生产,其他关键辅料如辅助脂质(Spikevax和Comirnaty都使用DSPC)、胆固醇、PEG化磷脂(Spikevax和Comirnaty分别使用PEG2000-DMG和ALC-0159)则是实现了国产化替代,可满足大规模产能供应需求。关键原辅料国产替代可避免因国外技术限制而被“卡脖子”,同时降低成本,也能在将来的“集采”中更具优势。
三、mRNA疫苗递送系统辅料的国产化
众所周知,mRNA疫苗是这两年国内外最炙手可热的“明星”技术,而脂质作为高端制剂的关键辅料,可供选择的供应商却屈指可数,更是鲜有本土供应。为避免在mRNA-LNP递送领域出现被高端辅料卡脖子的现象,厦门赛诺邦格(SINOPEG)在国内率先实现了脂质纳米粒递送材料的商业化生产,目前该公司拥有多款mRNA疫苗脂质辅料,并可根据客户委托进行定制生产。SINOPEG的多款产品(含定制结构)已经经过多家mRNA疫苗厂家的验证,拥有完整的质量研究资料。
新冠疫情大爆发极大地推进了mRNA疫苗的发展,同时也导致了LNP递送载体的供应短缺。在此关键时刻,基于多年的经验积累和强大的技术后盾,赛诺邦格及时为全球mRNA疫苗厂商填补了LNP递送载体的供应空缺,在短时间内实现了mRNA疫苗主流脂质的商业化生产,供应国内外企业;并可提供多个新型脂质辅料成功通过下游验证;同时承接客户定制开发需求,解决其GMP生产及申报等问题。
作为药物制剂的基础材料,药用辅料是药品和调配处方中除主药以外的重要非活性组成部分,能保证药物在体内按一定的速率和时间、在一定的部位释放,通过改变药物的理化性质使其向临床需求方向转变,在实现制剂技术目的方面起着至关重要的作用。因此,药品审评中心制定的《新型冠状病毒预防用mRNA疫苗药学研究技术指导原则(试行)》中,对于产品的质量要求,建议分析研究mRNA复合及成核效率、酸碱度、复合率和/或包封率、平均粒径和粒径分布、粒子微观形态、Zeta电位、渗漏/释放的评价、mRNA和免疫增强剂在各磷脂含量/比例、成品中药脂比、装载和未装载mRNA量(药物在脂质体中的分布情况/存在状态)、未形成组装结构的聚合物材料和正电荷脂质材料、氮磷比、辅料杂质等。如果适用,还建议进行成核颗粒聚集度、PEG密度等表征研究。
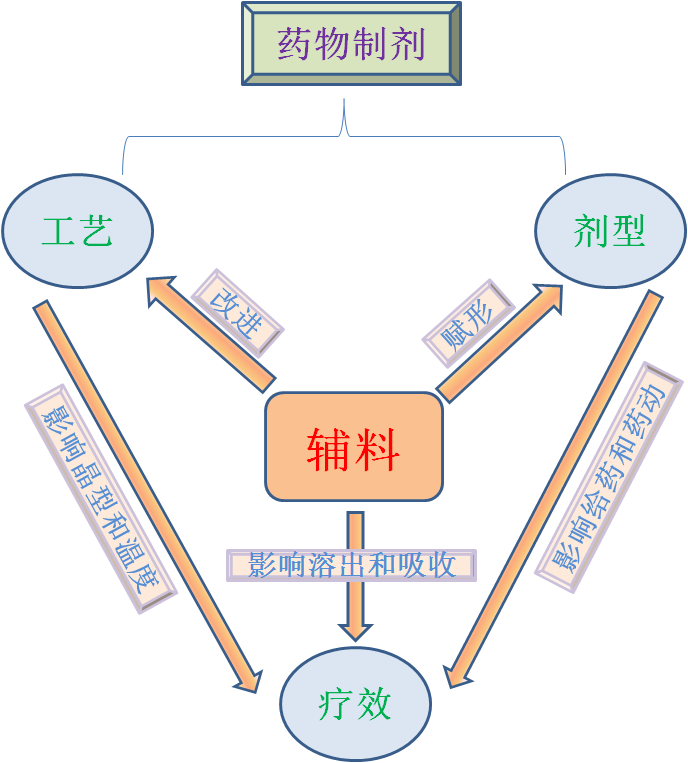
图5 辅料对制剂的全方位影响
作为国内外LNP递送系统辅料供应商,赛诺邦格的可电离脂质、PEG化脂质和辅助脂质,在质量及产业化上处于行业领先地位。为确保mRNA纳米颗粒制剂的均一性和质量可控性,明确辅料对产品关键质量属性(CriticalQuality Attribute,CQA))的影响,赛诺邦格根据研究结果拟定相关辅料的质量标准,从性状、含量、水分、异构体、有关物质、溶剂残留、微生物限度、细菌内毒素等多个方面严控辅料质量,囊括了物理、化学、生物、微生物四个维度的指标,确保产品的质量和可充分表征性。
赛诺邦格是全球领先的聚乙二醇及其衍生物生产商,能够提供从聚乙二醇聚合到聚乙二醇修饰脂质的一站式解决方案,从疫情爆发以来除持续向市场供应mRNA疫苗脂质辅料外,还为国内外其他的脂质辅料生产厂家提供高品质的聚乙二醇和聚乙二醇衍生物产品,如mPEG-OH、mPEG-CM、mPEG-CH2CH2CH2-NH2、mPEG-Epoxide、mPEG-DMG。公司同时还拥有ALC-0315及其类似物、ALC-0159类似物、SM-102及其类似物、DOPE、DSPC、DOTMA、DODMA、DTA、Dlin-MC3-DMA等脂质。除此之外,赛诺邦格也可帮助拥有自主知识产权的客户提供CMO代工服务。
目前,厦门赛诺邦格已先后在国家药品监督管理局药品审评中心完成ALC-0159、PEG2000-DMG、mPEG-Pglu、SM-102、ALC-0315、DOPE的备案登记,另有多个阳离子脂质将在年内完成备案或者关联审评。相信赛诺邦格定会在mRNA疫苗递送领域扮演越来越重要的角色。
表2 赛诺邦格已完成备案登记的脂质
|
产品名称 |
产品简称 |
备案登记号 |
|
甲氧基聚乙二醇双十四烷基乙酰胺-2K |
ALC-0159 |
F20210000384 |
|
甲氧基聚乙二醇二肉豆蔻酰甘油-2K |
PEG2000-DMG |
F20210000399 |
|
甲氧基聚乙二醇聚谷氨酸钠-12K |
mPEG-Pglu |
F20210000395 |
|
十七烷-9-基-8-((2-羟乙基)(6-氧代-6-((十一烷氧基)己基)氨基)辛酸酯) |
SM-102 |
F20210000505 |
|
1,2-二油酰-SN-甘油-3-磷酰乙醇胺 |
DOPE |
F20210000586 |
|
((4-羟基丁基)氮杂二烷基)双(己烷-6,1-二基)双(2-己基癸酸酯) |
ALC-0315 |
F20220000045 |
如有感兴趣的老师,请通过以下微信联系赛诺邦格:

参考文献:
康希诺专利和公告
石药集团公告
突破传统,石药深度布局:重仓mRNA及核酸药物
新型冠状病毒预防用mRNA疫苗药学研究技术指导原则(试行)
 在线留言
在线留言

















